La teoría cinética molecular, puede ser llamada también teoría cinética molecular de los gases. Los gases, aunque no son posibles notarlos a simple vista, están allí, y claramente existen. Esta teoría se enfoca en el estudio de los mismos, en el comportamiento de las moléculas en el cambio de materia y en la reacción que tengan ante diferentes agentes.
Los gases, tienen bastante solidez y fuerza de sugestión de una partícula hacia otra. Estos pueden tener cantidad de presiones bastante bajas y temperaturas relativamente altas. Todas están variantes dependerán de qué tipo de gas sea.
Contenido:
¿Qué es la teoría cinética molecular?
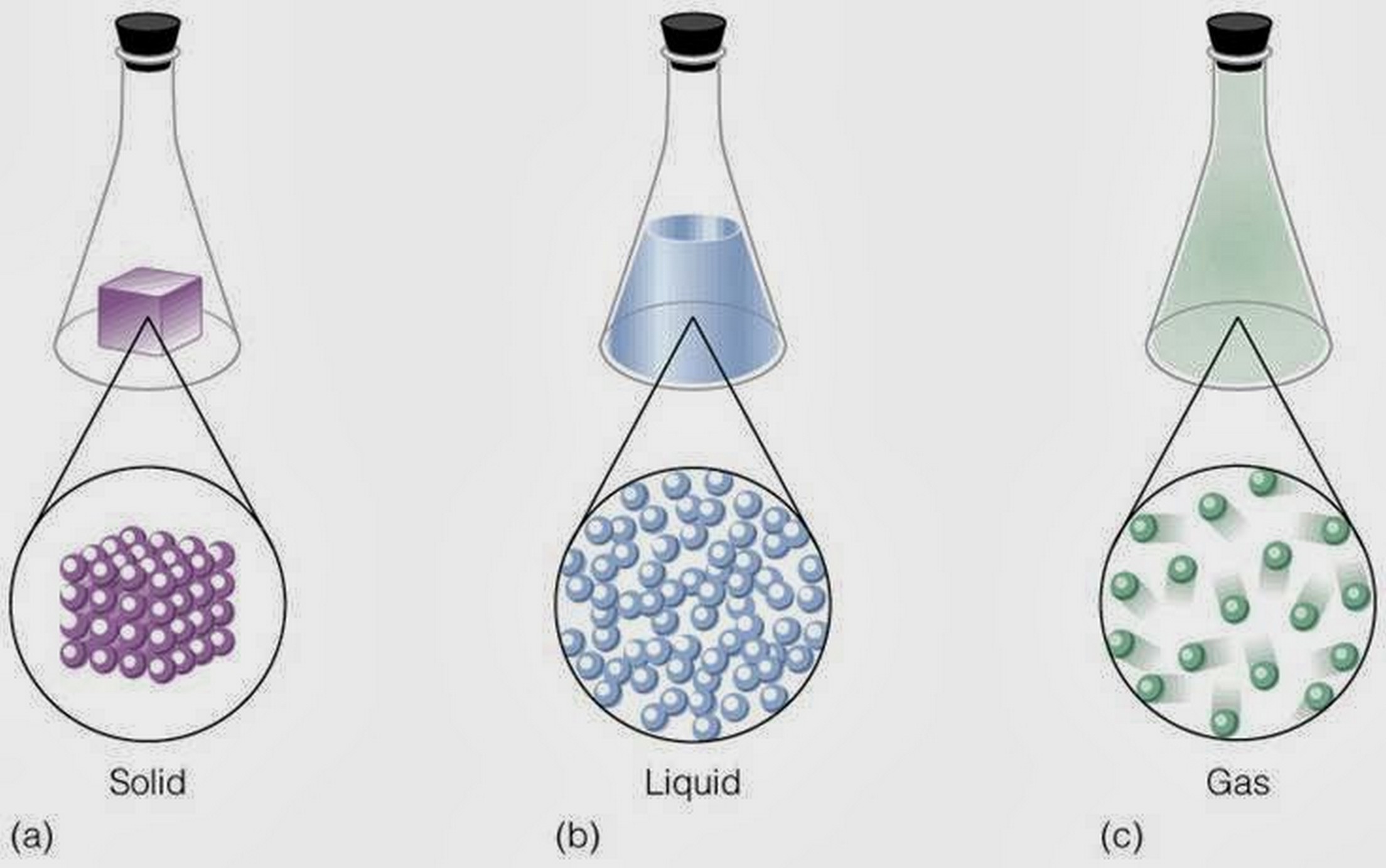
Lo que explica la teoría cinética molecular, es algo bastante sencillo, la transformación de las moléculas en los estados sólido, líquido y gaseoso. Siendo ya algo afirmado por profesionales, es que la teoría cinética molecular, es Todo, ¡Sí! ¡Todo! Todo lo que vemos, está constituido por lo que son partículas de diminuto tamaño y estas se desplazan y se mueven. Además, estas no pueden ser vistas, ni siquiera por los mejores microscopios existentes. Estas partículas son llamadas moléculas, y a su vez son las partículas que componen todos los cuerpos existentes. Siempre están en movimiento, y entre ellas, hay unas fuerzas que suelen llamarse “Fuerzas de Cohesión” mientras están en movimiento, suelen estar a un espacio de distancia.
¿Quién inventó la Teoría Cinética Molecular?
Esta Teoría, fue propuesta por el físico Alemán Rudolf Clausius. fue quien ha dado algún tipo de testimonio, acerca de lo que es la teoría cinética molecular química, puesto que él, relacionó e investigó todo tipo de cosas, y dio con esta excelente teoría. Se le considera el padre de la termodinámica.
5 Postulados de la teoría Cinética Molecular
- Las moléculas que componen a un gas, siempre están en movimiento constante, estas nunca paran de moverse de un lado a otro.
- Los espacios que existen entre todas las bacterias es mucho más grande que el tamaño de estas mismas, pues suelen ser excesivamente diminutas.
- El tamaño de la energía cinética de los elementos es directamente proporcional a las dimensiones de las mismas.
- Cuando chocan las moléculas, no hay ni pérdida ni ganancia de energía cinética, pues estos son bastante flexibles.
- Los elementos de un gas, son independientes de cualquier manera, no existe atracción molecular.
Ejemplos de la Teoría Cinética Molecular
Aquí te daremos algunos ejemplos de teoría cinética molecular, puesto que con ellos, sabrás aún más del tema. Estos son ejemplos de algunos de los postulados existentes.
- Cuando hablamos de esta, podemos decir, que está compuesta por una variedad de elementos. Los mismos caben en la posibilidad de ser elementos o también átomos, los cuales, al estar en forma líquida, gaseosa o sólida, siguen teniendo la misma forma.
- Los elementos siempre están en movimiento.
- Cuando los elementos chocan con las paredes del frasco o envase, estas se vuelven elásticas.
- Mientras más temperatura exista, mayor será el movimiento cinético.
Teoría Molecular de los Gases
Te has dado cuenta, que cuando existe aire encerrado en un frasco y este está cerrado ¿Suele emerger presión? Pues, esto se debe a que las moléculas habidas dentro de este, chocan unas con otras, y no encuentran una salida. Si el frasco en cuestión está roto, o partido, obviamente tiene agujeros, por estos, saldrán algunas de las moléculas que antes habitaban el interior del frasco, a esto suele llamársele efusibilidad.
Dado al estudio de las moléculas en estado gaseoso, se desarrolló la teoría cinética de los gases. Cuando dos gases suelen ponerse en contacto, las moléculas que componen uno de ellos, suelen unirse con el otro, de esta misma forma, realiza su trabajo el otro gas.
 Noticias y entretenimientos.
Noticias y entretenimientos.